青岛日报社/观海新闻11月24日讯 近日,中国海洋大学医药学院、海洋药物教育部重点实验室、青岛海洋科技中心海洋药物与生物制品功能实验室韩璐教授团队开发了一种血栓病理微环境ROS自驱动的纳米马达,协同NIR助力溶栓和血管修复。研究成果以“近红外光驱动纳米马达整合血小板-类囊体杂化膜用于溶栓与血管重塑协同治疗”为题发表在国际顶尖材料期刊《先进材料》。
血栓性心血管疾病的发病率正在持续攀升,严重威胁人类健康。由炎症、氧化应激、高血压、高血糖、缺氧等因素诱导的血管内皮损伤,进而可能导致血管阻塞、血流中断及缺血性器官损伤。关键的是,血栓部位的受损内皮细胞可引发炎症损伤,并产生高浓度的过氧化氢(H2O2)。这种高浓度H2O2自我强化的氧化应激循环通过释放炎症因子和血小板活化加剧内皮功能障碍。目前,大多数抗血栓策略主要集中于溶解血栓,却未能解决潜在的病理微环境问题。因此,内皮损伤往往持续存在,使患者易发生血栓复发。因此,开发能够同时溶解血栓并修复血管内皮的纳米治疗剂,成为一项迫切的临床需求。
针对以上问题,研究团队成功研发了一种以病理微环境驱动为核心的纳米马达系统,该系统的核心由掺锶离子(Sr2+)的介孔聚多巴胺纳米颗粒(PSr NPs)构成,它既作为纳米马达的主体,也是氧化应激触发下释放Sr2+的储存库,同时还能清除活性氧。为了实现双重靶向推进,在PSr NPs表面整合一层由血小板膜(PM)和菠菜来源类囊体膜(TKM)组成的杂化膜。基于血小板膜的靶向性与类囊体膜的类过氧化氢酶活性,该结构能精准抵达血栓部位,并将H2O2分解为O2以驱动纳米马达自主运动,最终通过抑制炎症与氧化应激来减轻血小板-内皮粘附。在近红外(NIR)光照下,PSr NPs产生温和的光热效应(约40℃),通过直接热溶栓及增强纳米马达渗透实现双重溶栓效果。与此同时,从PSr NPs中可控的Sr2+释放可促进内皮再生与屏障修复,从而阻断血栓复发的恶性循环。该纳米系统在多种跨物种模型中均展现出普适性溶栓功效,包括斑马鱼花生四烯酸诱导的血栓模型和小鼠三氯化铁诱导的颈动脉栓塞模型。通过将植物光合膜的催化功能与哺乳动物系统的靶向精准性相结合,这种跨物种协同作用开创了仿生纳米技术的新范式。该仿生结构将生物信号传导(血小板-内皮识别)与物理刺激响应(光热驱动)有机融合,从而在促进深层血栓渗透的同时重塑微环境。这一多维度治疗策略将“瞬时溶栓”升级为“可持续血管功能恢复”,为精准抗血栓治疗提供了一个具有转化潜力的纳米平台。(青岛日报/观海新闻记者 杨琪琪)
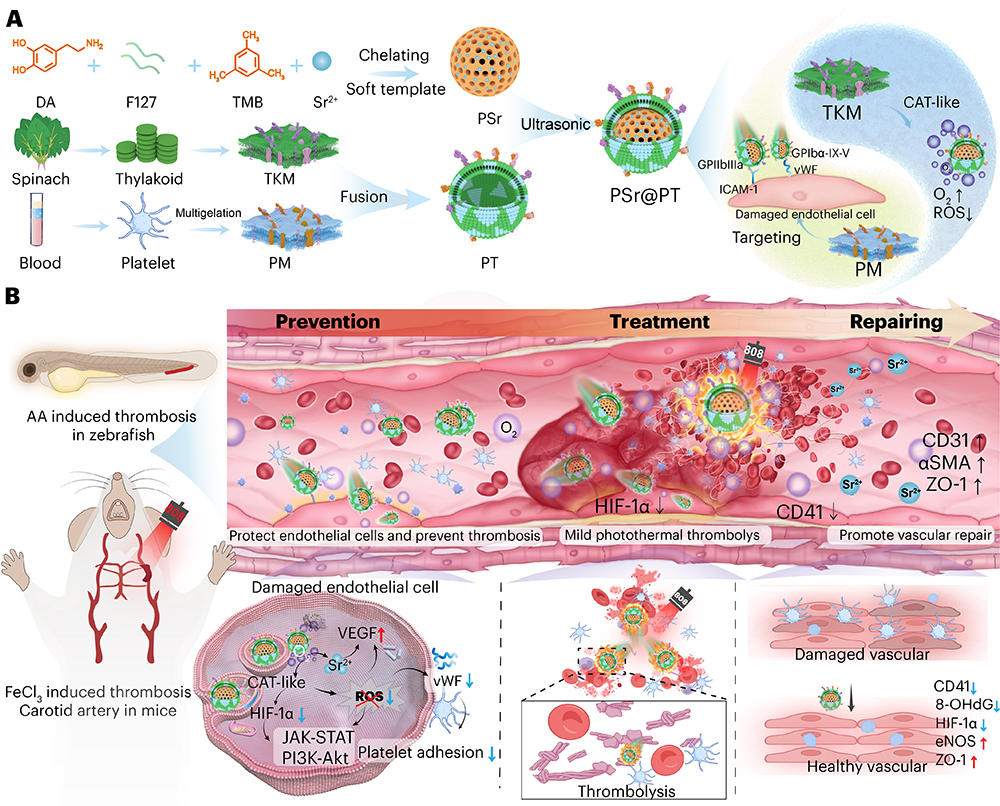
(病理微环境驱动自主运动的纳米马达通过血小板膜靶向受损内皮细胞,实现ROS驱动自主运动并缓解氧化应激,通过光热效应增强血栓的渗透与溶解,并进一步促进血管微环境的修复。)
责任编辑:王臻



